جواب در میان تارنماها صفحه ۱۳ شیمی (۱)
با مراجعه به منابع علمی معتبر مانند وبگاه «آیوپاک» و وبگاه «انجمن شیمی ایران» دربارۀ دسته بندی عنصرها به روشهای دیگر، اطلاعاتی جمع آوری و نتایج خود را به کلاس گزارش کنید.
دانشمندان با مطالعه بر روی عناصر متوجه شده بودند که با وجود تفاوت بین خواص عنصرها مشابهت فیزیکی و شیمیایی بین عناصر وجود دارد. تفاوتها نیز از نظم و ترتیب خاصی پیروی میکند.
طبقه بندی عناصر، با توجه به تشابه برخی از عنصرها با یک دیگر، و نظم و ترتیب موجود در تغییرات خواص آنها امکان پذیر بود.
* اولین دسته بندی توسط لاوازیه صورت گرفت. لاوازیه عناصر را به دو دسته فلز و نافلز تقسیم کرد.
* دوبراینر دانشمند دیگری است که عناصر را در دستههای سه تایی به جدول زیر تقسیم بندی کرد.
نیوزلند براساس قانون اکتاو (گام های موسیقی) هفت عنصر را در هفت دسته هفت تایی دسته بندی کرد. در این دسته بندی خواص فیزیکی و شیمیایی در عنصر هشتم تکرار میشد.
اولین دانشمندی که عناصر را طبقه بندی کرد مندلیف روسی بود. مندلیف به تغییرات خواص عناصر توجه نمود. او با بیان قانون تناوبی جدول خود را عرضه کرد.
مندلیف در تنظیم جدول دو اصل را رعایت کرد.
۱- اصل تشابه خواص عناصر (قرار گرفتن عناصر با خاصیتهای مشابه در زیر هم در یک ستون)
۲- افزایش تدریجی جرم اتمی عناصر در ردیف های کنار هم (تغییر تدریجی خواص)
مندلیف عناصر شناخته شده زمان خود را در چند ردیف (دوره - تناوب) براساس افزایش جرم اتمی از چپ به راست منظم نمود. به گونهای که عناصر با خواص مشابه زیر یکدیگر در یک ستون قرار بگیرند.
این کار باعث شد خانههای خالی متعددی از عناصر که در زمان مندلیف کشف نشده بود پیش بینی شود. در نتیجه قدم بزرگ در راه کشف این عناصر توسط محققین برداشته شود.
ایراد جدول مندلیف: چند مورد بی نظمی دیده میشد و آن این بود که برای رعایت اصول تشابه مجبور شد عناصر سنگینتر را قبل از عناصر سبکتر قرار دهد.
قانون تناوبی مندلیف: اگر عنصرها به ترتیب افزایش جرم اتمی در کنار هم در ردیف قرار گیرند خواص فیزیکی و شیمیایی آنها به طور تناوبی تکرار میشود.
بعد ها موزلی با کشف عدد اتمی (تعداد پروتونهای هسته) نشان داد که عدد اتمی معیار مناسب تری برای تنظیم عناصر در جدول تناوبی است. بر همین اساس موزلی معیار تنظیم عناصر در جدول را تغییر داد. به طور که در جدول تناوبی امروزی عناصر بر مبنای عدد اتمی (نه جرم اتمی) تنظیم شدهاند.
قانون تناوبی جدول امروزی: براساس کار موزلی - قانون تناوبی عناصر - هر گاه عناصر را براساس افزایش عدد اتمی در کنار یکدیگر قرار دهیم خواص فیزیکی و شیمیایی آنها به طور تناوبی تکرار میشود.
جواب خود را بیازمایید صفحه ۱۳ شیمی (۱)
۱- با استفاده از جدول دورهای، موقعیت (دوره و گروه) عنصرهای آلومینیم ($_{۱۳}Al$)، کلسیم ($_{۲۰}Ca$)، منگنز ($_{۲۵}Mn$) و سلنیم ($_{۳۴}Se$) را تعیین کنید.
| اتم | دوره | گروه |
|---|---|---|
| $_{۱۳}Al$ | ۳ | ۱۳ |
| $_{۲۰}Ca$ | ۴ | ۲ |
| $_{۲۵}Mn$ | ۴ | ۷ |
| $_{۳۴}Se$ | ۴ | ۱۶ |
۲- هلیم ($_{۲}He$)، عنصری است که تمایل به انجام واکنش شیمیایی ندارد. پیش بینی کنید کدام یک از عنصرهای زیر، رفتاری مشابه با آن دارد؟ چرا؟
$_{۱۸}Ar$، زیرا این اتم، هم گروه هلیم است و اتم های هم گروه خواص شیمیایی یکسان دارند.
۳- اتم فلوئو ($_{۹}F$)، ترکیب با فلزها به یون فلوئورید ($F^-$) تبدیل میشود. اتم کدام یک از عنصرهای زیر، میتواند آنیونی با بار الکتریکی همانند یون فلوئورید تشکیل دهد؟ چرا؟
$_{۳۵}Br$، زیرا این عنصر، هم گروه فلوئور است
۴- از اتم آلومینیم ($_{۱۳}Al$)، یون پایدار $Al^-$ شناخته شده است. پیش بینی کنید اتم کدام یک از عنصرهای زیر میتواند به کاتیونی مشابه $Al^+$ در ترکیبها تبدیل شود؟
$_{۳۱}Ga$ ، زیرا هر دو عنصر دارای ۳ الکترون ظرفیتی بوده و در یک گروه قرار دارند.
جواب با هم بیندیشیم صفحه ۱۵ شیمی (۱)
۱- با توجه به شکل به پرسشهای زیر پاسخ دهید.
آ) جدول زیر را کامل کنید.
| نماد ایزوتوپ | درصد فراوانی در طبیعت | (A)عدد جرمی | جرم اتمی میانگین |
|---|---|---|---|
| $_{۳}^{۶}Li$ | ۶% | ۶ | ۶/۹۴ |
| $_{۳}^{۷}Li$ | ۹۴% | ۷ | ۶/۹۴ |
ب) جرم اتمی میانگین هر عنصر همان جرم نشان داده شده در جدول دورهای عنصرهاست. رابطهای بین جرم اتمی میانگین، درصد فراوانی و جرم اتمی ایزوتوپها بنویسید.
\begin{align} & \chi =\frac{{{m}_{۱}}{{a}_{۱}}+{{m}_{۲}}{{a}_{۲}}+...}{۱۰۰} \\ \end{align}
۲- شکل روبه رو ایزوتوپهای کلر را نشان میدهد.(۱)
آ) جرم اتمی میانگین کلر را حساب کنید.
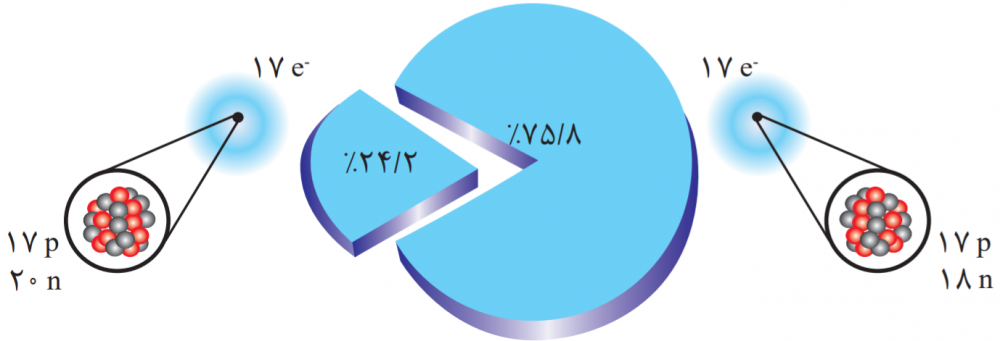
کلر دارای دو ایزوتوپ است که با توجه به نمودار دایرهای درصد فراوانی آنها به صورت زیر است:
\begin{align} & _{۱۷}^{۳۷}Cl \to ۲۴/۲\% \\ & _{۱۷}^{۳۵}Cl \to ۷۵/۸\% \\ \end{align}
\begin{align} & \chi =\frac{{{m}_{۱}}{{a}_{۱}}+{{m}_{۲}}{{a}_{۲}}+...}{۱۰۰}=\frac{(۳۷\times ۲۴/۲)+(۳۵\times ۷۵/۸)}{۱۰۰} \\ & \chi=\frac{۸۹۵/۴+۲۶۵۳}{۱۰۰}=۳۵/۴۸۴ \\ \end{align}
ب) جرم اتمی میانگین به دست آمده را با جرم اتمی کلر در جدول دورهای مقایسه کنید.
جرم اتمی محاسبه شده با فرمول مقداری کمتر از مقدار موجود در جدول تناوبی است.
جواب با هم بیندیشیم صفحه ۱۶ شیمی
| ماده | جرم ۱۰۰۰عدد (گرم) | جرم ۵۰عدد (گرم) | جرم ۱عدد (گرم) |
|---|---|---|---|
| کاغذ A۴ | ۴۵۰۰ | ۲۲۵ | ۴/۵ |
| عدس | ۵۶ | ۲/۸ | ۰/۰۵۶ |
| برنج | ۲۲ | ۱/۱ | ۰/۰۲۲ |
| خاکشیر | ۲ | ۰/۱ | ۰/۰۰۲ |
ب) به نظر شما جرم یک عدد از کدام ماده را میتوان با ترازوی دیجیتالی اندازه گیری کرد؟ چرا؟
کاغذ آ۴، زیرا جرم یک عدد کاغذ آ۴، در حد گرم میباشد و دقت ترازوی دیجیتالی در حد گرم است.
پ) روشی برای اندازه گیری جرم یک دانه خاکشیر ارائه کنید.
میتوان با ترازوی دیجیتالی یک گرم از این ماده را وزن کرد و سپس با شمارش دانههای آن و تقسیم نمودن جرم بر تعداد دانه، جرم یک دانهی خاکشیر را به دست آورد.
ت) آیا جرم هر یک از دانههای برنج موجود در نمونه با جرم به دست آمده در ستون چهارم جدول برابر است؟ توضیح دهید.
خیر، زیرا جرم هر یک از دانههای برنج به اندازه و ابعاد آن دانه وابسته است.
اتمها به طور باور نکردنی ریز هستند به طوری که نمیتوان با هیچ دستگاهی و شمارش تک تک آنها، شمار آنها را به دست آورد؛ اما دریافتید که از روی جرم مواد میتوان شمار ذرههای سازنده را شمارش کرد. اینک حدس بزنید که چگونه میتوان شمار اتمهای موجود در یک نمونه عنصر را شمارش کرد؟
از تقسیم جرم آن ماده بر جرم اتمی میانگین اتمهای آن ماده
جواب پیوند با ریاضی صفحه ۱۷ شیمی (۱)
۱- دانشمندان با استفاده از دستگاهی به نام طیف سنج جرمی، جرم اتمها را با دقت زیاد اندازه گیری میکنند. اگر بدانید که جرم یک اتم هیدروژن برابر با $۱amu=۱/۶۶\times {{۱۰}^{-۲۴}}$ است، حساب کنید در نمونۀ یک گرمی از عنصر هیدروژن، چند اتم هیدروژن وجود دارد؟
\begin{align} & ?atom H=۱g H \times \frac {۱atom He}{۱/۶۶ \times ۱۰^{۲۴}g H} = ۶/۰۲ \times {۱۰^{۲۳}} atom H \\ \end{align}
۲- به عدد به دست آمده در پرسش ۱، عدد آووگادرو میگویند و آن را با $N_A$ نشان میدهند. اکنون مشخص کنید اگر به تعداد $N_A$ اتم هیدروژن در یک نمونه موجود باشد، جرم آن چند گرم است؟
\begin{align} & ?g H=۶/۰۲ \times {۱۰^{۲۳}} atom H \times \frac {۱/۶۶ \times۱۰^{-۲۴}g H}{۱atom H} = ۱g H \\ \end{align}
جواب خود را بیازمایید صفحه ۱۹ شیمی (۱)
با استفاده از $۱molAl=۲۷gAl$، $۱molS=۳۲gS$ و عاملهای تبدیل مناسب حساب کنید:
آ) ۵ مول آلومینیم چند گرم جرم دارد؟
\begin{align} & ۵molAl\times \frac{۲۶gAl}{۱molAl}=۱۳۵gAl \\ \end{align}
ب) ۰/۰۸ گرم گوگرد چند مول گوگرد است؟
\begin{align} & ۰/۰۸gS\times \frac{۱molS} {۳۲gS}=۰/۰۰۲۵molS \\ \end{align}
۲- دانش آموزی برای تعیین تعداد اتم های موجود در ۰/۲ مول فلز روی، محاسبۀ زیر را به درستی انجام داده است. هر یک از جاهای خالی را پرکنید.
\begin{align} & ?atom Zn=۰/۲ {mol Zn} \times \frac {۶/۰۲ \times ۱۰^{۲۳} atomZn}{۱ molZn} \\ & =۱/۲۰۴ \times {{۱۰}^{۲۳}} atomZn\\ \end{align}
۳- حساب کنید $۹/۰۳\times {{۱۰}^{۲۰}}$ اتم مس، چند مول و چند گرم مس است؟
\begin{align} & ۹/۰۳\times {{۱۰}^{۲۰}}atomCu\times \frac{۱molCu}{۶/۰۲\times {{۱۰}^{۲۳}}atomCu}\\ & =۱/۵\times {{۱۰}^{-۳}}molCu \\ & =۱/۵\times {{۱۰}^{-۳}}molCu\times \frac{۶۳/۵۵gCu}{۱molCu}\\ &=۰/۰۹۵gCu \\ \end{align}


